随着全球人口老龄化的不断加剧,带状疱疹日益成为了影响老年人生活质量的疾病,预防老年人罹患带状疱疹的疫苗也逐渐成为了增进民众健康的不二之选。
根据弗若斯特沙利文数据,按销售收入计算,中国带状疱疹疫苗市场有望在2030年迎来285亿的大市场。目前国内带状疱疹疫苗市场是双寡头格局,只有GSK的Shingrix®和百克生物的感维®获批上市。
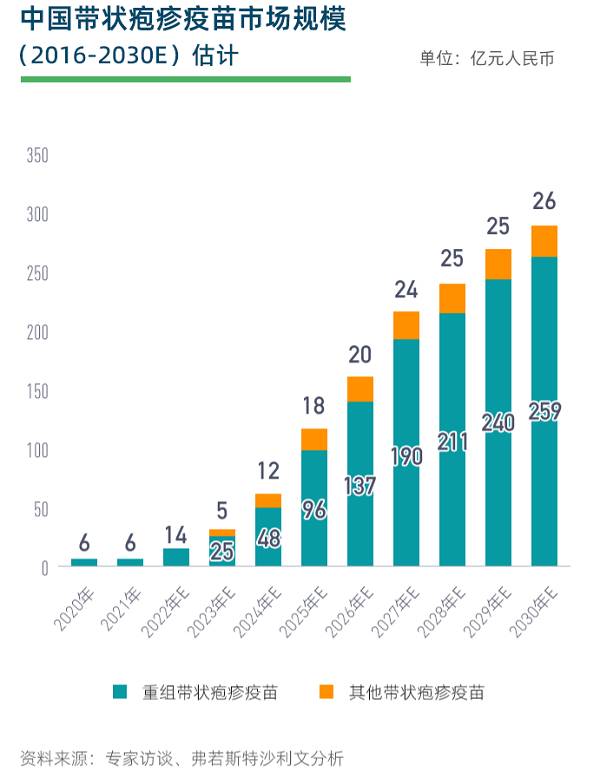
从赛道的竞争格局来看,该赛道的资本市场新贵绿竹生物-B(02480.HK)也参与了带状疱疹疫苗研发,从研发进度和技术路径来看,绿竹生物是国内重组带疱疫苗临床进展最快、已披露数据最好的一家,竞争潜力不容小觑。
公开资料显示,绿竹生物已在9月28日宣布正式启动重组带状疱疹疫苗LZ901的三期临床研究,该疫苗也是除Shingrix®外全球第二家进入三期临床研究的重组带状疱疹疫苗。若绿竹生物产品最终上市,将带给市场多大的冲击?本文将从技术路线、临床进度、临床数据、出海情况等方面来进行分析。
技术路线:重组蛋白路线保护率更优
重组疫苗、减毒活疫苗与RNA疫苗,是目前带状疱疹疫苗研发的三条主流技术路线。
最早上市的减毒活疫苗,由于其较低的保护效率、较短的保护期限,逐渐被重组蛋白疫苗所替代。而RNA技术路线的带状疱疹疫苗,由于其新技术面世时间不长,仍需长时间验证。
重组带状疱疹疫苗的主流地位从两方面表现:其一,Shingrix®垄断全球市场,在其上市后第三年(即2020年11月),减毒疫苗Zostavax®不再于美国售卖。2022年,Shingrix®在全球的销售额约为36亿美元。2023年,GSK披露第二季度财报显示,Shingrix®销售额同比增长20%,仅半年时间就销售高达约22亿美元。其二,目前处于临床阶段的其他在研的带状疱疹疫苗大都选择重组蛋白路线,说明其市场认可程度高。
临床进度:绿竹生物断档式领先
从国内公司竞争格局来看,绿竹生物的技术路线是重组蛋白路线,已于2023年9月进入三期临床研究,研发进度断档式领先。
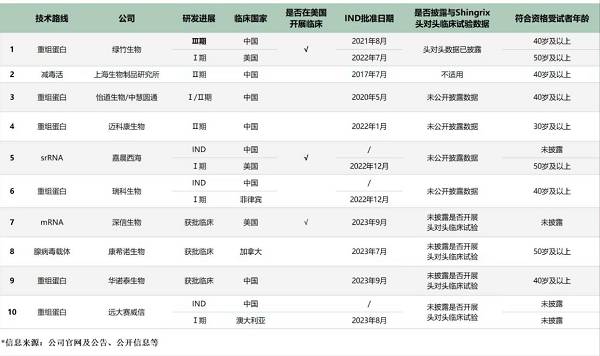
据绿竹生物9月28日公告披露,其已于江苏、山东、湖北和山西等四个省份启动了其核心产品LZ901的多中心、随机、双盲、安慰剂对照设计,用于评价在40岁及以上成人中预防带状疱疹保护效力、安全性的三期临床试验,总入组规模约2.6万人,截至公告日已完成首批受试者入组。

临床数据:安全性和免疫原性优秀
LZ901是绿竹生物自主研发的在研重组带状疱疹疫苗及核心产品,为全球首款具有四聚体分子结构的带状疱疹疫苗。
与天然存在的VZV抗原相比,其分子结构具有双倍的Fc区供抗原呈递细胞(APC)结合,LZ901主动向免疫细胞呈递VZV抗原以触发免疫反应。此外,LZ901在临床前研究中表现出高免疫原性和安全性,同时诱导出特异性体液和细胞免疫。
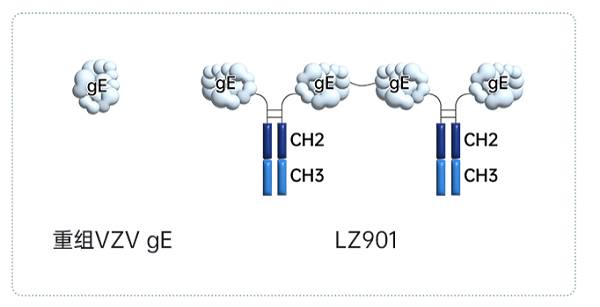
与Shingrix®相比,LZ901的具备以下优势:
首先,副作用小。诚如LZ901在中国的一期和二期临床试验安全性数据证明,施用LZ901的受试者的一级至三级AE的总体数量和发生率均远低于施用Shingrix®的受试者。且Shingrix®海外三期临床数据显示其总体三级不良反应率超过20%,而LZ901目前二期临床数据显示其疫苗组三级不良反应率仅为1%。
此外,该公司采用的剂型为方便易用的液体制剂。绿竹生物在研重组带状疱疹疫苗LZ901采用了高度稳定的液体制剂配方,可以方便地储存和运输。它在37˚C下可稳定两周,在25˚C下稳定12周,在2-8˚C下可稳定的存放24个月以上。由于液体制剂只含有常规使用的氢氧化铝佐剂,不含免疫刺激物,减少了注射部位发生严重不良反应的可能性,因此,施用LZ901的副作用很小。
其次,强保护。根据从LZ901在中国的一期临床试验所收集的免疫原性数据,其证明与Shingrix®相比,在全程接种LZ901后,抗VZV抗体水平并无显著差异。而且,LZ901诱导更强细胞免疫反应,对带状疱疹应有很强的保护作用。在人体头对头试验中,与Shingrix®相比,LZ901诱导更强的细胞免疫反应,辅助T细胞(CD4+)及细胞毒性T细胞(CD8+)表达多种类型的免疫细胞启动生物标志物的细胞比例更高。这表明LZ901在诱导细胞免疫方面不弱于Shingrix®,LZ901提供强大的带状疱疹保护。
值得一提的是,LZ901定价更具竞争力。与Shingrix®全程接种约3200元的定价相比,LZ901的定价将更适合中国国情,更具有性价比。国内按照批签发口径计算GSK带状疱疹疫苗渗透率仅为0.3%左右,渗透率提升空间较大。
出海情况:第一家中美同时临床的疫苗 两地上市增量空间可期
在出海大趋势下,国内创新药企们陆续尝试了海外授权(license out)等多种出海模式。随着出海经验积累,在中美两地同时展开临床试验这一新模式逐渐在创新药企中流行。
今年2月,绿竹生物在美国纽约启动重组带状疱疹疫苗LZ901的一期临床研究,是该赛道内国内首个在中美两地同时进行临床研究的企业。到目前为止,也仍然是唯一获得FDA批准临床的国产重组带疱疫苗。
同时据绿竹生物9月28日的公告披露,其近日已于日本取得LZ901的发明专利注册。除美国、欧洲、英国、韩国、加拿大、澳大利亚的在申请专利外,绿竹生物已获得中国、俄罗斯和日本的专利批准。
绿竹生物加速出海,是顺应行业发展趋势的举措,也是国产疫苗创新的一个重大里程碑。一方面,国内的医保定价体系正在倒逼创新药企出海以获取更大利润空间;另一方面,Biotech企业们要打开估值空间,出海也是必然要走的路径。而企业一旦决心要出海,作为全球最大医药市场的美国必然是绕不过去的。因此,绿竹生物作为出海先行者,反映了绿竹生物是以全球药物开发的视角来研发药物,更表露出其全球化布局的雄心。
若能顺利在全球市场上市,绿竹生物的增量空间值得期待。以Shingrix®为例,带状疱疹疫苗Shingrix® 2022年全年实现销售收入36亿美元,中国、德国市场同比增长超过100%,刷新了自上市来的销售记录。GSK认为Shingrix®在2026年的销售收入有望超过40亿英镑。
绿竹生物重组带疱疫苗临床进展再进一步,则意味着其研发稳步推进,产品向市场化脚步加快。此外,公司产品不仅效果出众且价格极具竞争力,若顺利上市,将颠覆这一产业竞争格局。创新药的投资逻辑在于技术卡位,从这一点来看,绿竹生物的价值巨大。

.png)
 北京家恩德仁医院开展胃肠镜检查啦!这6类人群必须要做!
北京家恩德仁医院开展胃肠镜检查啦!这6类人群必须要做! 行业利好:NMN在中国合规化进行时,跨境电商清理不合规进口NMN产品
行业利好:NMN在中国合规化进行时,跨境电商清理不合规进口NMN产品 共筑社会“安全感”|沃尔沃汽车鼎力支持上海市“医苑新星”结业仪式
共筑社会“安全感”|沃尔沃汽车鼎力支持上海市“医苑新星”结业仪式 汇仁能量小黑瓶:中药智慧点亮都市人群健康生活
汇仁能量小黑瓶:中药智慧点亮都市人群健康生活 汇仁肾宝片——三朝经典古方,临床实证安全高效
汇仁肾宝片——三朝经典古方,临床实证安全高效 微循环障碍是百病之源
微循环障碍是百病之源